Содержание
Федеральный закон от 22 декабря 2020 г. N 460-ФЗ «О внесении изменений в Федеральный закон «О техническом регулировании» и Федеральный закон «О внесении изменения в статью 4 Закона Российской Федерации «О защите прав потребителей»»
Принят Государственной Думой 9 декабря 2020 года
Одобрен Советом Федерации 16 декабря 2020 года
Статья 1
Внести в Федеральный закон от 27 декабря 2002 года N 184-ФЗ «О техническом регулировании» (Собрание законодательства Российской Федерации, 2002, N 52, ст. 5140; 2005, N 19, ст. 1752; 2007, N 19, ст. 2293; N 49, ст. 6070; 2008, N 30, ст. 3616; 2009, N 29, ст. 3626; N 48, ст. 5711; 2010, N 1, ст. 5, 6; N 40, ст. 4969; 2011, N 30, ст. 4603; N 49, ст. 7025; N 50, ст. 7351; 2012, N 31, ст. 4322; N 50, ст. 6959; 2013, N 30, ст. 4071; 2014, N 26, ст. 3366; 2015, N 17, ст. 2477; N 27, ст. 3951; N 29, ст. 4342; N 48, ст. 6724; 2016, N 15, ст. 2066; 2017, N 27, ст. 3938; N 31, ст. 4765; 2018, N 49, ст. 7521) следующие изменения:
7521) следующие изменения:
1) в статье 2:
а) дополнить новыми абзацами четырнадцатым и пятнадцатым следующего содержания:
«недействительность декларации о соответствии — основание для прекращения органом государственного контроля (надзора) за соблюдением требований технических регламентов, национальным органом по аккредитации действия декларации о соответствии в случаях, установленных в соответствии с настоящим Федеральным законом. Действие декларации о соответствии прекращается с момента внесения сведений о признании декларации о соответствии недействительной в реестр выданных сертификатов соответствия и зарегистрированных деклараций о соответствии (далее — реестр сертификатов соответствия и деклараций о соответствии), включающий в себя в том числе национальную часть Единого реестра выданных сертификатов соответствия и зарегистрированных деклараций о соответствии Евразийского экономического союза;
недействительность сертификата соответствия — основание для прекращения органом государственного контроля (надзора) за соблюдением требований технических регламентов, национальным органом по аккредитации действия сертификата соответствия в случаях, установленных в соответствии с настоящим Федеральным законом.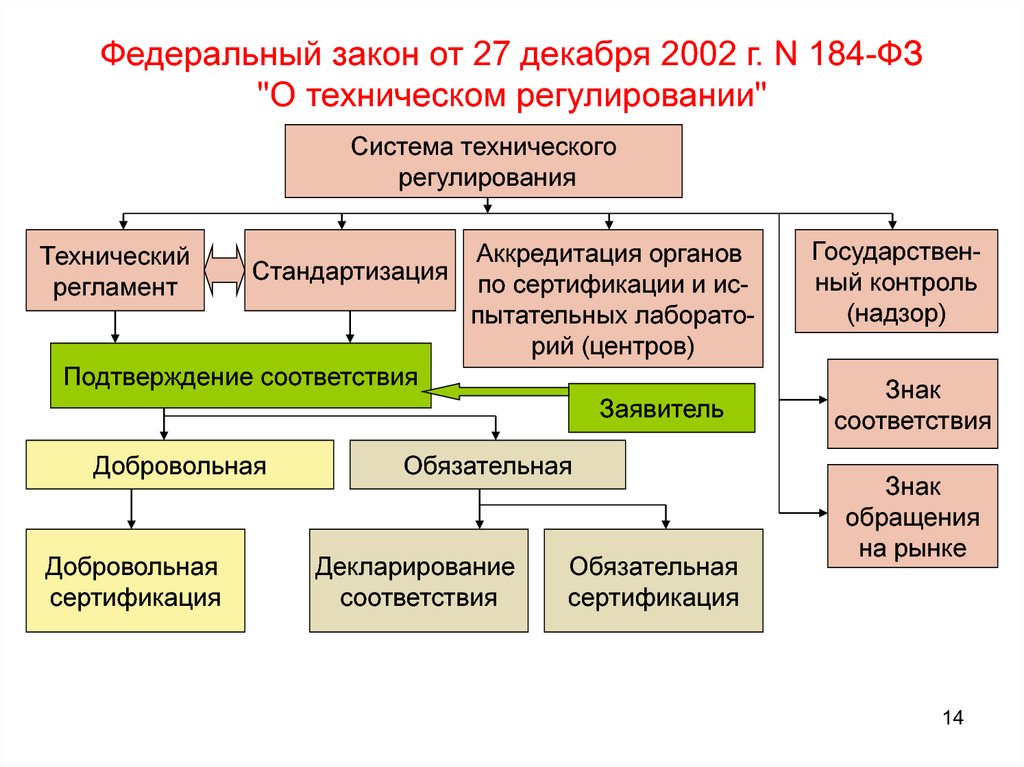 Действие сертификата соответствия прекращается с момента внесения сведений о признании сертификата соответствия недействительным в реестр сертификатов соответствия и деклараций о соответствии;»;
Действие сертификата соответствия прекращается с момента внесения сведений о признании сертификата соответствия недействительным в реестр сертификатов соответствия и деклараций о соответствии;»;
б) абзацы четырнадцатый — тридцать седьмой считать соответственно абзацами шестнадцатым — тридцать девятым;
в) дополнить абзацем следующего содержания:
«эксперт-аудитор — физическое лицо, которое является работником органа по сертификации, обладает знаниями и навыками проведения работ по подтверждению соответствия в определенной области, включено в единый реестр экспертов-аудиторов и участвует в работах по обязательной сертификации, выполняемых органом по сертификации.»;
2) в пункте 3 статьи 4 второе предложение исключить;
3) главу 1 дополнить статьей 56 следующего содержания:
«Статья 56. Особенности технического регулирования в области космической деятельности
Особенности технического регулирования в области космической деятельности устанавливаются Законом Российской Федерации от 20 августа 1993 года N 5663-I «О космической деятельности». «;
«;
4) пункт 1 статьи 19 дополнить абзацем следующего содержания:
«независимости эксперта-аудитора от изготовителей, продавцов, исполнителей и приобретателей, в том числе потребителей, при проведении работ по сертификации.»;
5) абзац пятый пункта 1 статьи 21 дополнить словами «, в которых указывается, что подтверждение соответствия данных объектов осуществляется в рамках системы добровольной сертификации в случае, если выдача сертификатов соответствия установлена правилами системы добровольной сертификации»;
6) пункт 3 статьи 23 дополнить абзацами следующего содержания:
«Порядок формирования и ведения реестра сертификатов соответствия и деклараций о соответствии устанавливается Правительством Российской Федерации. Указанным порядком предусматриваются в том числе правила определения предельного объема сертификатов соответствия, выдаваемых органами по сертификации.
Организация формирования и ведения реестра сертификатов соответствия и деклараций о соответствии осуществляется национальным органом по аккредитации.
При формировании и ведении реестра сертификатов соответствия и деклараций о соответствии должны быть обеспечены механизмы резервного копирования и восстановления содержащихся в нем сведений.
Сведения, вносимые в реестр сертификатов соответствия и деклараций о соответствии, должны подписываться усиленной квалифицированной электронной подписью уполномоченного лица.»;
7) в статье 24:
а) абзац двенадцатый пункта 5 изложить в следующей редакции:
«Форма декларации о соответствии и состав сведений, содержащихся в декларациях о соответствии, утверждаются федеральным органом исполнительной власти по техническому регулированию по согласованию с национальным органом по аккредитации и иными заинтересованными федеральными органами исполнительной власти.»;
б) пункты 6 и 7 изложить в следующей редакции:
«6. Оформленная заявителем в соответствии с пунктом 5 настоящей статьи и подписанная усиленной квалифицированной электронной подписью заявителя либо уполномоченного заявителем лица декларация о соответствии подлежит регистрации в электронной форме в реестре сертификатов соответствия и деклараций о соответствии и начинает действовать с момента присвоения ей регистрационного номера.
7. Заявитель обязан представить регистрационный номер декларации о соответствии и доказательственные материалы по требованию органа государственного контроля (надзора) за соблюдением требований технических регламентов.»;
в) дополнить пунктом 8 следующего содержания:
«8. Регистрация, приостановление, возобновление, прекращение действия деклараций о соответствии, признание их недействительными осуществляются в порядке, установленном Правительством Российской Федерации. Указанным порядком предусматриваются в том числе:
случаи принятия органами государственного контроля (надзора) за соблюдением требований технических регламентов, национальным органом по аккредитации решений о приостановлении, возобновлении, прекращении действия деклараций о соответствии, признании их недействительными;
сроки принятия органами государственного контроля (надзора) за соблюдением требований технических регламентов, национальным органом по аккредитации решений о приостановлении, возобновлении, прекращении действия деклараций о соответствии, признании их недействительными;
порядок информирования заявителей, приобретателей, в том числе потребителей, о приостановлении, возобновлении, прекращении действия деклараций о соответствии, признании их недействительными.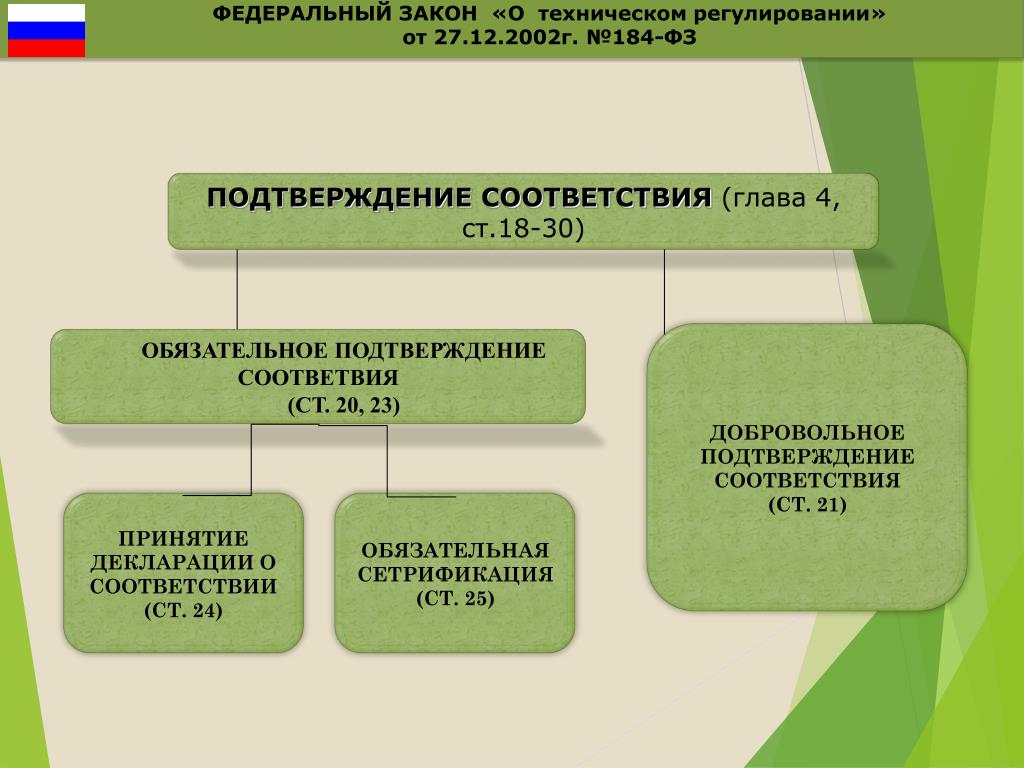 «;
«;
8) в статье 25:
а) абзацы тринадцатый и четырнадцатый пункта 2 изложить в следующей редакции:
«Срок действия сертификата соответствия определяется соответствующим техническим регламентом. В случае расхождения сведений между сертификатом соответствия, выданным на бумажном носителе, и сведениями, внесенными в реестр сертификатов соответствия и деклараций о соответствии, приоритет имеют сведения, внесенные в реестр сертификатов соответствия и деклараций о соответствии.
Форма сертификата соответствия и состав сведений, содержащихся в сертификатах соответствия, утверждаются федеральным органом исполнительной власти по техническому регулированию по согласованию с национальным органом по аккредитации и иными заинтересованными федеральными органами исполнительной власти.»;
б) дополнить пунктами 21 и 22 следующего содержания:
«21. Орган по сертификации, выдавший сертификат соответствия на серийно выпускаемую продукцию, обязан проводить периодическую оценку сертифицированной продукции (далее — инспекционный контроль) в порядке и с периодичностью, которые предусмотрены требованиями права Евразийского экономического союза и законодательства Российской Федерации о техническом регулировании. Сведения о прохождении инспекционного контроля подлежат включению в реестр сертификатов соответствия и деклараций о соответствии.
Сведения о прохождении инспекционного контроля подлежат включению в реестр сертификатов соответствия и деклараций о соответствии.
В случаях непроведения в установленный срок инспекционного контроля, если инспекционный контроль предусмотрен техническим регламентом, схемой обязательной сертификации, договором, или непредставления органом по сертификации сведений о прохождении инспекционного контроля в реестр сертификатов соответствия и деклараций о соответствии сертификат соответствия прекращает действие по истечении 30 дней со дня наступления последнего дня месяца, в котором должен быть проведен инспекционный контроль, но не позднее чем по истечении одного года со дня прекращения действия аккредитации (сокращения области аккредитации в соответствующей части) аккредитованного лица, который выдал сертификат соответствия, аккредитация которого в качестве органа по сертификации была прекращена или область аккредитации которого была сокращена в соответствии с законодательством Российской Федерации об аккредитации в национальной системе аккредитации (в части проведения соответствующих работ по обязательной сертификации). Сведения о прекращении действия сертификата соответствия вносятся органом по аккредитации в реестр сертификатов соответствия и деклараций о соответствии. В случае невозможности проведения инспекционного контроля орган по сертификации обязан уведомить об этом заявителя за 30 дней до истечения срока проведения инспекционного контроля.
Сведения о прекращении действия сертификата соответствия вносятся органом по аккредитации в реестр сертификатов соответствия и деклараций о соответствии. В случае невозможности проведения инспекционного контроля орган по сертификации обязан уведомить об этом заявителя за 30 дней до истечения срока проведения инспекционного контроля.
В случае прекращения в соответствии с абзацем вторым настоящего пункта действия сертификата соответствия, выданного в отношении серийно выпускаемой продукции, выпущенной в обращение на основании такого сертификата соответствия, данная продукция может находиться в обращении в течение срока ее годности или срока службы, установленных в соответствии с законодательством Российской Федерации, без проведения новых процедур по оценке соответствия при условии, что данная продукция произведена до даты прекращения действия указанного сертификата соответствия.
22. В случае прекращения аккредитации органа по сертификации (сокращения области аккредитации) заявитель вправе заключить договор о передаче сертификата соответствия, выданного на серийно выпускаемую продукцию, в том числе по выполнению инспекционного контроля, с иным аккредитованным в национальной системе аккредитации органом по сертификации с действующей на момент передачи сертификата соответствия областью аккредитации, распространяющейся на продукцию, которая была сертифицирована.
Орган по сертификации, с которым был заключен договор о передаче сертификата соответствия, выданного на серийно выпускаемую продукцию, пользуется всеми правами и несет все обязанности и ответственность, которые предусмотрены законодательством Российской Федерации для органа по сертификации, выдавшего сертификат соответствия.»;
9) в статье 26:
а) в пункте 2:
дополнить новым абзацем третьим следующего содержания:
«несет ответственность в соответствии с законодательством Российской Федерации за достоверность, полноту и объективность оценки документов, принятых в качестве доказательств соответствия продукции требованиям технического регламента и послуживших основанием для принятия решения о подтверждении соответствия;»;
абзац третий считать абзацем четвертым и изложить его в следующей редакции:
«осуществляет инспекционный контроль, если инспекционный контроль предусмотрен соответствующими техническим регламентом, схемой обязательной сертификации и (или) договором о проведении инспекционного контроля, в случае поступления от органов государственного контроля (надзора) информации о претензиях к безопасности продукции либо в случае, если поступившая информация ставит под сомнение результаты ранее принятого решения по сертификации продукции;»;
абзацы четвертый и пятый считать соответственно абзацами пятым и шестым;
абзац шестой считать абзацем седьмым и дополнить его после слов «информирует об этом» словом «заявителя,»;
абзацы седьмой — девятый считать соответственно абзацами восьмым — десятым;
абзац десятый считать абзацем одиннадцатым и дополнить его после слов «(центры) или» словами «, если это предусмотрено законодательством Российской Федерации,»;
абзац одиннадцатый считать абзацем двенадцатым;
дополнить абзацами следующего содержания:
«осуществляет оценку заявителя на соответствие положениям технического регламента, определяющим круг заявителей для конкретного объекта подтверждения соответствия;
рассматривает информацию органа государственного контроля (надзора) о необходимости приостановления или прекращения действия сертификата соответствия, принимает решение о приостановлении или прекращении действия сертификата соответствия либо об отсутствии такой необходимости и направляет в орган государственного контроля (надзора) в течение десяти рабочих дней мотивированный ответ с результатами рассмотрения указанной информации;
исполняет предписание органа государственного контроля (надзора) либо национального органа по аккредитации о приостановлении или прекращении действия сертификата соответствия, принимает решение о приостановлении или прекращении действия сертификата соответствия;
в течение трех рабочих дней со дня заключения с заявителем договора о передаче сертификата соответствия в случае, установленном пунктом 22 статьи 25 настоящего Федерального закона, представляет соответствующие сведения в национальный орган по аккредитации с использованием федеральной государственной информационной системы в области аккредитации;
обладает иными правами и обязанностями в соответствии с настоящим Федеральным законом и иными нормативными правовыми актами Российской Федерации. «;
«;
б) дополнить пунктами 21 — 24 следующего содержания:
«21. Для проведения работ по обязательной сертификации орган по сертификации привлекает экспертов-аудиторов.
22. Эксперт-аудитор:
выполняет работы по обязательной сертификации;
соблюдает требования законодательства о техническом регулировании;
подписывает сертификат соответствия.
23. Порядок подтверждения компетентности эксперта-аудитора, а также требования к экспертам-аудиторам устанавливаются Правительством Российской Федерации.
24. Порядок формирования и ведения единого реестра экспертов-аудиторов устанавливается Правительством Российской Федерации. Организацию формирования и ведения единого реестра экспертов-аудиторов осуществляет национальный орган по аккредитации.»;
в) пункт 3 изложить в следующей редакции:
«3. Порядок приостановления, возобновления, прекращения действия сертификатов соответствия, признания их недействительными устанавливается Правительством Российской Федерации. Указанным порядком предусматриваются в том числе:
Указанным порядком предусматриваются в том числе:
случаи и сроки принятия органами государственного контроля (надзора) за соблюдением требований технических регламентов, национальным органом по аккредитации решений о приостановлении, возобновлении, прекращении действия сертификатов соответствия, признании их недействительными;
особенности прекращения действия сертификатов соответствия, признания недействительными сертификатов соответствия, выданных органами по сертификации, аккредитация которых была прекращена либо область аккредитации которых была сокращена (в части проведения соответствующих работ по обязательной сертификации) в соответствии с законодательством Российской Федерации об аккредитации в национальной системе аккредитации;
порядок информирования органов по сертификации, заявителей, приобретателей, в том числе потребителей, о приостановлении, возобновлении, прекращении действия сертификатов соответствия, признании их недействительными.»;
10) в статье 27:
а) в пункте 1 слова «соответствие которой требованиям технических регламентов» заменить словами «которая подлежит обязательному подтверждению соответствия, в том числе до дня вступления в силу технических регламентов, и соответствие которой»;
б) пункт 2 изложить в следующей редакции:
«2. Маркировка знаком обращения на рынке осуществляется изготовителем или заявителем самостоятельно любым удобным для него способом до выпуска продукции в обращение. Особенности маркировки продукции, соответствующей требованиям технических регламентов, знаком обращения на рынке устанавливаются техническими регламентами.
Маркировка знаком обращения на рынке осуществляется изготовителем или заявителем самостоятельно любым удобным для него способом до выпуска продукции в обращение. Особенности маркировки продукции, соответствующей требованиям технических регламентов, знаком обращения на рынке устанавливаются техническими регламентами.
Продукция, соответствие которой не подтверждено в порядке, установленном настоящим Федеральным законом, не может быть маркирована знаком обращения на рынке.»;
11) в статье 28:
а) пункт 1 дополнить абзацем следующего содержания:
«получать в органе по сертификации, выдавшем ему сертификат соответствия, документы и материалы, которые подтверждают результаты сертификации и условия и срок предоставления которых определяются договором о сертификации.»;
б) абзац шестой пункта 2 дополнить словами «, сертификат соответствия или декларация о соответствии признаны недействительными, за исключением случая, предусмотренного абзацем третьим пункта 21 статьи 25 настоящего Федерального закона»;
12) в абзаце втором пункта 1 статьи 29 слова «принятого указом Президента Российской Федерации или» заменить словами «принятого федеральным законом, или указом Президента Российской Федерации, или»;
13) в статье 31:
а) слово «Аккредитация» заменить словами «1. Аккредитация»;
Аккредитация»;
б) дополнить пунктом 2 следующего содержания:
«2. В случаях и порядке, которые установлены Правительством Российской Федерации, национальный орган по аккредитации принимает решение о признании недействительными документов, выданных аккредитованными испытательными лабораториями в результате их деятельности.»;
14) пункт 1 статьи 34 изложить в следующей редакции:
«1. На основании положений настоящего Федерального закона и требований технических регламентов органы государственного контроля (надзора) вправе:
требовать от изготовителя (продавца, лица, выполняющего функции иностранного изготовителя) представления информации о регистрационном номере сертификата соответствия или декларации о соответствии, если наличие таких документов предусмотрено соответствующим техническим регламентом;
осуществлять мероприятия по государственному контролю (надзору) за соблюдением требований технических регламентов в порядке, установленном законодательством Российской Федерации;
выдавать предписания об устранении нарушений требований технических регламентов в срок, установленный с учетом характера нарушения;
направлять информацию о необходимости приостановления или прекращения действия сертификата соответствия в выдавший его орган по сертификации и национальный орган по аккредитации;
выдавать предписание о приостановлении или прекращении действия сертификата соответствия выдавшему его органу по сертификации, выдавать предписание о приостановлении или прекращении действия декларации о соответствии лицу, принявшему декларацию, и направлять информацию о выдаче предписания о приостановлении или прекращении действия сертификата соответствия, декларации о соответствии в национальный орган по аккредитации;
привлекать изготовителя (исполнителя, продавца, лицо, выполняющее функции иностранного изготовителя) к ответственности, предусмотренной законодательством Российской Федерации;
требовать от изготовителя (лица, выполняющего функции иностранного изготовителя) предоставления доказательственных материалов, использованных при осуществлении обязательного подтверждения соответствия продукции требованиям технического регламента;
принимать решение о приостановлении, прекращении действия сертификата соответствия, декларации о соответствии, признании их недействительными в порядке, установленном Правительством Российской Федерации;
принимать иные меры, предусмотренные законодательством Российской Федерации, в целях недопущения причинения вреда. «;
«;
15) пункт 3 статьи 38 дополнить словами «, незамедлительно прекратить действие декларации о соответствии на продукцию»;
16) в статье 41 слова «и должностное лицо органа по сертификации» заменить словами «, должностное лицо органа по сертификации и эксперт-аудитор»;
17) абзац одиннадцатый пункта 1 статьи 45 изложить в следующей редакции:
«формирование и ведение реестра сертификатов соответствия и деклараций о соответствии;»;
18) в статье 46:
а) абзац второй пункта 2 признать утратившим силу;
б) пункт 3 изложить в следующей редакции:
«3. Правительством Российской Федерации до дня вступления в силу соответствующих технических регламентов утверждаются и ежегодно уточняются единый перечень продукции, подлежащей обязательной сертификации, и единый перечень продукции, подлежащей декларированию соответствия.
Обязательное подтверждение соответствия в отношении продукции, указанной в абзаце первом настоящего пункта, осуществляется органом по сертификации в соответствии с порядком обязательного подтверждения соответствия, утверждаемым Правительством Российской Федерации. Правительство Российской Федерации вправе утвердить перечень национальных стандартов Российской Федерации, содержащих правила сертификации, применение которых органом по сертификации является обязательным при проведении обязательной сертификации в отношении продукции, подлежащей обязательному подтверждению соответствия в соответствии с настоящим пунктом.
Правительство Российской Федерации вправе утвердить перечень национальных стандартов Российской Федерации, содержащих правила сертификации, применение которых органом по сертификации является обязательным при проведении обязательной сертификации в отношении продукции, подлежащей обязательному подтверждению соответствия в соответствии с настоящим пунктом.
Продукция, соответствие которой подтверждено в порядке, предусмотренном настоящей статьей, маркируется знаком обращения на рынке в соответствии со статьей 27 настоящего Федерального закона.
Порядок маркирования продукции, соответствие которой подтверждено в порядке, предусмотренном настоящей статьей, устанавливается федеральным органом исполнительной власти по техническому регулированию. Признание недействительными документов, выданных в рамках процедур обязательного подтверждения соответствия продукции требованиям, указанным в пункте 1 настоящей статьи, осуществляется в соответствии с настоящим Федеральным законом и принятыми в соответствии с ним нормативными правовыми актами.
Сведения о выданных сертификатах соответствия на продукцию, включенную в единый перечень продукции, подлежащей обязательной сертификации, за исключением сертификатов соответствия на продукцию, для которой устанавливаются требования, связанные с обеспечением безопасности в области использования атомной энергии, и сведения о декларациях о соответствии продукции, включенной в единый перечень продукции, подлежащей декларированию соответствия, включаются в реестр сертификатов соответствия и деклараций о соответствии в порядке, установленном в соответствии со статьей 23 настоящего Федерального закона.
Регистрация деклараций о соответствии продукции, включенной в единый перечень продукции, подлежащей декларированию соответствия, приостановление, возобновление, прекращение действия указанных деклараций о соответствии, признание их недействительными осуществляются в соответствии со статьей 24 настоящего Федерального закона.
Федеральный орган исполнительной власти по техническому регулированию по согласованию с национальным органом по аккредитации и иными заинтересованными федеральными органами исполнительной власти утверждает форму сертификата соответствия и состав сведений, содержащихся в сертификатах соответствия на продукцию, включенную в единый перечень продукции, подлежащей обязательной сертификации, за исключением сертификатов соответствия на продукцию, для которой устанавливаются требования, связанные с обеспечением безопасности в области использования атомной энергии, форму декларации о соответствии и состав сведений, содержащихся в декларациях о соответствии продукции, включенной в единый перечень продукции, подлежащей декларированию соответствия. «;
«;
в) в пункте 8 слова «об аккредитации, выданные в установленном порядке органам по сертификации и аккредитованным испытательным лабораториям (центрам) до вступления в силу настоящего Федерального закона, а также документы» исключить;
г) в пункте 9 слова «за получением аттестата аккредитации на соответствующую область аккредитации либо на расширение области аккредитации» заменить словами «за получением аккредитации в национальной системе аккредитации либо расширением области аккредитации»;
д) в абзаце втором пункта 10 слова «знаком соответствия» заменить словами «знаком обращения на рынке», слова «с порядком, установленным абзацем седьмым пункта 3 настоящей статьи» заменить словами «со статьей 24 настоящего Федерального закона»;
е) дополнить пунктом 13 следующего содержания:
«13. До дня вступления в силу изменений в Закон Российской Федерации от 20 августа 1993 года N 5663-I «О космической деятельности», устанавливающих особенности технического регулирования в области космической деятельности, обязательная оценка соответствия космической техники осуществляется в соответствии с правовыми актами и нормативными документами федеральных органов исполнительной власти, правопреемником которых является Государственная корпорация по космической деятельности «Роскосмос», принятыми до дня вступления в силу настоящего Федерального закона. «.
«.
Статья 2
Внести в Федеральный закон от 2 декабря 2019 года N 425-ФЗ «О внесении изменения в статью 4 Закона Российской Федерации «О защите прав потребителей» (Собрание законодательства Российской Федерации, 2019, N 49, ст. 6984; 2020, N 14, ст. 2028) следующие изменения:
1) в статье 1:
а) абзац второй изложить в следующей редакции:
«41. При продаже отдельных видов технически сложных товаров с предварительно установленными программами для электронных вычислительных машин потребителю обеспечивается возможность использовать отдельные виды технически сложных товаров с предварительно установленными программами для электронных вычислительных машин, странами происхождения которых являются Российская Федерация или другие государства — члены Евразийского экономического союза. Перечень отдельных видов указанных технически сложных товаров, порядок составления и ведения перечня программ для электронных вычислительных машин, странами происхождения которых являются Российская Федерация или другие государства — члены Евразийского экономического союза и которые должны быть предварительно установлены, и порядок их предварительной установки, включая требования к функционированию, определяются Правительством Российской Федерации. «;
«;
б) дополнить абзацем следующего содержания:
«Предварительно установленные программы для электронных вычислительных машин, используемые потребителем на отдельных видах технически сложных товаров для доступа к информации на сайтах в информационно-телекоммуникационной сети «Интернет», должны обеспечивать возможность использования без дополнительных настроек (по умолчанию) поисковой системы, страной происхождения которой является Российская Федерация или другие государства — члены Евразийского экономического союза, в порядке, установленном Правительством Российской Федерации. Требования к указанной поисковой системе и порядок ее определения устанавливаются Правительством Российской Федерации.».»;
2) статью 2 изложить в следующей редакции:
«Статья 2
1. Настоящий Федеральный закон вступает в силу с 1 апреля 2021 года, за исключением абзаца третьего статьи 1 настоящего Федерального закона.
2. Абзац третий статьи 1 настоящего Федерального закона вступает в силу с 1 июля 2021 года. «.
«.
Статья 3
1. Настоящий Федеральный закон вступает в силу по истечении ста восьмидесяти дней после дня его официального опубликования, за исключением положений, для которых настоящей статьей установлены иные сроки вступления их в силу.
2. Подпункт «а» пункта 9, подпункт «а» пункта 11, пункт 15 статьи 1, статья 2 настоящего Федерального закона вступают в силу со дня официального опубликования настоящего Федерального закона.
3. Пункт 12 статьи 1 настоящего Федерального закона вступает в силу с 1 января 2021 года.
4. Подпункт «в» пункта 1, пункт 4, подпункт «б» пункта 9, пункт 16 статьи 1 настоящего Федерального закона вступают в силу по истечении одного года после дня официального опубликования настоящего Федерального закона.
5. В отношении сертификатов соответствия на серийно выпускаемую продукцию, выданных до дня вступления в силу настоящего Федерального закона и действующих либо приостановленных на день вступления в силу настоящего Федерального закона, органы по сертификации, выдавшие такие сертификаты соответствия, либо органы по сертификации, с которыми в соответствии с абзацем первым пункта 22 статьи 25 Федерального закона от 27 декабря 2002 года N 184-ФЗ «О техническом регулировании» заключен договор о передаче сертификата соответствия, в том числе по выполнению периодической оценки сертифицированной продукции, в течение 90 дней со дня вступления в силу настоящего Федерального закона вносят в реестр выданных сертификатов соответствия и зарегистрированных деклараций о соответствии, включающий в себя в том числе национальную часть Единого реестра выданных сертификатов соответствия и зарегистрированных деклараций о соответствии Евразийского экономического союза, сведения о прохождении периодической оценки сертифицированной продукции.
6. Сертификаты соответствия, выданные до дня вступления в силу настоящего Федерального закона, действуют до окончания срока их действия.
Президент Российской Федерации В. Путин
Изменения в № 184-ФЗ О техническом регулировании — Центр сертификации Ростест
Отзывы о круглом столе
Академия РОСТЕСТ провела в онлайн-формате круглый стол, посвященный изменениям в № 184-ФЗ “О техническом регулировании”. Изменения утверждены в декабре 2020 года Федеральным законом № 460-ФЗ “О внесении изменений в Федеральный закон “О техническом регулировании” и Федеральный закон “О внесении изменения в статью 4 Закона Российской Федерации “О защите прав потребителей”. Основная часть изменений вступает в силу с 21 июня 2021 года. РОСТЕСТ оперативно отреагировал на нововведения и в прямом эфире обсудил их со своими клиентами и партнерами 26 февраля. Как правильно подготовиться к выполнению новых требований, какие риски учесть – рассказали заместитель генерального директора по оценке соответствия Нина Мощенская, заместитель руководителя органа по сертификации “РОСТЕСТ-Москва” по пищевому направлению Елена Нечаева и юрисконсульт Юлия Васильцюн.
Новые требования закона спикеры условно разделили на две группы: те, что непосредственно относятся к заявителям, и те, что касаются аккредитованных лиц и повлияют на заявителей опосредованно.
Изменения в № 184-ФЗ наделяют контрольно-надзорные органы новыми полномочиями и вводят понятия “недействительность деклараций о соответствии” и “недействительность сертификатов соответствия”. Согласно определениям закона, недействительность декларации и сертификата – основание для прекращения в установленных случаях их действия контрольно-надзорными органами (органами государственного контроля за соблюдением требований технических регламентов, органом государственного контроля за деятельностью аккредитованных лиц). Принимать решение о приостановлении, прекращении действия сертификата или декларации, признании их недействительными надзорные органы будут в порядке, установленном Правительством РФ. Как отметили эксперты, уже готовится соответствующий проект нормативного правового акта, определяющий такой порядок, прошла стадия обсуждения уведомления о разработке проекта.
Спикеры отметили: хотя закон не вводит такое понятие, как недействительность протокола испытаний, он все же также закрепляет право национального органа по аккредитации признавать недействительными документы, выданные аккредитованными испытательными лабораториями. И здесь запускается определенная цепочка: если контрольно-надзорный орган выявляет недействительность протокола испытаний, то автоматически будет признаваться недействительным и разрешительный документ, выданный на основании этого протокола (декларация или сертификат). Таковы будут последствия признания недействительными протоколов испытаний для заявителя. Для органа по сертификации, включенного в национальную часть единого реестра, в соответствии с постановлением Правительства РФ № 1236 взаимодействие в рамках сертификации с аккредитованной испытательной лабораторией, допустившей массовую или систематическую выдачу документов, признанных недействительными, будет являться достаточной причиной для его исключения из национальной части единого реестра органов по оценке соответствия ЕАЭС.
Нередко случается, что у заявителей нет четкого понимания, как действовать, когда в результате контрольно-надзорных мероприятий выявлено то или иное несоответствие. Чтобы прояснить порядок действий, эксперты привели схему, на которой показали, как происходит взаимодействие и обмен информацией о несоответствиях между изготовителями, потребителями, приобретателями, другими заинтересованными лицами и органами надзора с учетом требований № 184-ФЗ, а также новых законов № 248-ФЗ “О государственном контроле (надзоре) и муниципальном контроле в Российской Федерации” и № 247-ФЗ “Об обязательных требованиях в Российской Федерации”.
Эксперты обратили внимание участников круглого стола на новое положение № 184-ФЗ о приоритете сведений, внесенных в реестр сертификатов и деклараций, в случае их расхождения со сведениями, указанными в сертификате или декларации на бумажном носителе, и напомнили о необходимости получения электронной цифровой подписи – требование заверять ею сведения, вносимые в реестр сертификатов соответствия и деклараций, также закреплено в № 184-ФЗ.
Было рассмотрено, кто и когда должен проводить маркирование продукции знаком обращения. Закон определяет, что эта процедура проводится изготовителем или заявителем самостоятельно до выпуска продукции в обращение. Однако пока не определено, каким именно знаком обращения на рынке, согласно соответствующему требованию закона, должна быть промаркирована продукция, которая включена в единый перечень продукции (постановление Правительства РФ № 982) и не попадает под действие технических регламентов Евразийского экономического союза и Российской Федерации.
Переходя к рассмотрению новых требований № 184-ФЗ, касающихся органов по сертификации, эксперты отметили, что эти изменения опосредованно повлияют и на заявителей.
Согласно одному из таких изменений, результаты инспекционного контроля становятся публичными: сведения о его прохождении должны быть включены в реестр сертификатов соответствия. Если же инспекционный контроль не будет проведен в установленный срок или орган по сертификации не предоставит в реестр сертификатов соответствия посредством ФГИС сведения о его прохождении, то действие сертификата будет прекращено. Эксперты обсудили, какова зона ответственности органа по сертификации, какие связанные с ней права и обязанности у него есть по проведению инспекционного контроля, в том числе внепланового, и пояснили, какой должна быть периодичность планового инспекционного контроля. Заявителям нужно быть готовым к прохождению инспекционного контроля не реже одного раза в год, подчеркнули спикеры.
Эксперты обсудили, какова зона ответственности органа по сертификации, какие связанные с ней права и обязанности у него есть по проведению инспекционного контроля, в том числе внепланового, и пояснили, какой должна быть периодичность планового инспекционного контроля. Заявителям нужно быть готовым к прохождению инспекционного контроля не реже одного раза в год, подчеркнули спикеры.
Спикеры обратили внимание на закрепление на законодательном уровне нового термина “эксперт-аудитор”, предполагающего наличие у работника органа по сертификации профессиональной компетенции по проведению аудита в рамках серийной сертификации. Именно такой подход реализован в РОСТЕСТе, но готов ли к изменениям рынок и не будет ли компетентность таких экспертов оцениваться по формальным признакам, усомнились спикеры.
Большой интерес также вызывает вопрос, как отразится на заявителях новая норма закона об установлении регулятором предельного объема сертификатов соответствия, выдаваемых органами по сертификации. Эксперты предположили, что предельный объем сертификатов для органа будет установлен, скорее всего, исходя из его ресурсов по численности персонала и некоего расчетного значения трудоемкости проведения сертификации. Такая мера является не чем иным, как регулированием рынка услуг по сертификации, подчеркнули спикеры, и вкупе с требованиями к экспертам-аудиторам вызовет определенный передел рынка, что, в свою очередь, отразится на стоимости и сроках проведения сертификации.
Эксперты предположили, что предельный объем сертификатов для органа будет установлен, скорее всего, исходя из его ресурсов по численности персонала и некоего расчетного значения трудоемкости проведения сертификации. Такая мера является не чем иным, как регулированием рынка услуг по сертификации, подчеркнули спикеры, и вкупе с требованиями к экспертам-аудиторам вызовет определенный передел рынка, что, в свою очередь, отразится на стоимости и сроках проведения сертификации.
В конце мероприятия эксперты ответили на вопросы, заданные участниками, об использовании электронной цифровой подписи, формы проведения инспекционного контроля и передачи сведений о его результатах, маркировке продукции знаком обращения и другие актуальные вопросы, волнующие участников мероприятия.
Присоединяйтесь к обсуждению актуальных тем технического регулирования, участвуйте в наших мероприятиях!
Отзывы о круглом столе
Знак обращения на рынке
«СТР» в России: последние изменения в ФЗ «О техническом регулировании»
21 июня 2021 г. вступил в силу Федеральный закон от 22 декабря 2020 г. № 460-ФЗ, которым вносятся изменения в Федеральный закон от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании». в силу.
вступил в силу Федеральный закон от 22 декабря 2020 г. № 460-ФЗ, которым вносятся изменения в Федеральный закон от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании». в силу.
Одним из важных изменений, внесенных Федеральным законом № 460-ФЗ, является пересмотр требований к маркировке продукции. Отныне продукция, подлежащая обязательному подтверждению соответствия в соответствии с национальными стандартами Российской Федерации (ГОСТ Р) или техническими регламентами Российской Федерации*, должна маркироваться знаком обращения на рынке «СТР» (« СТР ») вместо знака соответствия «РСТ» (« РСТ »).
* Не путать с Техническим регламентом Таможенного (Евразийского) союза, требующим наличия знака соответствия ЕАС.
В Постановление внесен новый раздел XVIII, посвященный порядку маркировки продукции знаком обращения на рынке, которым устанавливается единый знак для всей продукции, подлежащей подтверждению соответствия: «Продукция, соответствие которой подтверждено в порядке, предусмотренном настоящего Указа, маркируются знаком обращения на рынке».
Примеры оборудования/продукции, подлежащей обязательному подтверждению соответствия в соответствии с национальными стандартами РФ, расположены ниже:
- Посуда, напр. тарелки, стаканы, миски;
- Товары для дома в аэрозольной упаковке;
- Высоковольтное оборудование.
Положения Постановления распространяются только на ту продукцию, которая подлежит оценке соответствия после 21 июня 2021 года. Продукция, прошедшая оценку соответствия до этой даты и имеющая установленную маркировку знаком соответствия (« РСТ » — ИССО) могут обращаться на рынке с этим знаком соответствия в течение срока действия сертификата или декларации ГОСТ Р. Однако это допускается только до 22 июня 2022 года.
Знак соответствия наносится на каждой единицы продукции. При невозможности нанесения его на сами изделия используются этикетки, упаковка и сопроводительные документы. Место, где будет размещен знак, выбирает изготовитель или заявитель. Знак должен быть хорошо виден, устойчив к внешним воздействиям, нанесен безопасным для товара способом и оставаться разборчивым в течение всего срока его действия.
Знак должен быть хорошо виден, устойчив к внешним воздействиям, нанесен безопасным для товара способом и оставаться разборчивым в течение всего срока его действия.
НОВОСТИ
С началом конфликта между Украиной и Россией транспортировка грузов в эти районы сильно нарушена. Каковы текущие маршруты и как они работают?
…
Владельцы бизнеса, если на вашу деятельность повлияла война в Украине, получите поддержку от вашей ТПП.
…
С февраля ЕС ввел пять пакетов санкций против России, включая адресные ограничительные меры (индивидуальные санкции), экономические санкции и дипломатические меры.
…
Вступило в силу Постановление Правительства Российской Федерации № 353 «Об особенностях разрешительной деятельности в Российской Федерации в 2022 году».
…
ВМЕСТЕ НА 2022 ГОД
…
Перечень оборудования, работающего под давлением, подлежащего оценке соответствия согласно ТР ТС 032/2013 «О безопасности оборудования, работающего под давлением» обновлен и вступает в силу в новой редакции с 1 января 2022 года.
…
Планируются изменения в ТР ТС 004/2011 «О безопасности низковольтного оборудования» и ТР ТС 020/2011 «Электромагнитная совместимость технических устройств»: актуализация терминологии и процедур сертификации ЕАС соответствия и Декларация соответствия ЕАС
. ..
..
Нормативные требования
Наши подразделения соответствуют перечисленным требованиям
Больничное обслуживание
Правовая основа в области управления качеством: Формальная структура руководства по IMS основана на рекомендациях международных стандартов DIN EN ISO 9001:2008 и DIN EN ISO 13485. С точки зрения содержания и информативности процессов в соответствии с требованиями DIN EN ISO 9001 и DIN EN ISO 13485 Руководство «Интегрированные системы менеджмента» следует следующим законам и стандартам:
- DIN EN ISO 9001Системы менеджмента качества – требования представления QM в проектировании, разработке, производстве, монтаже и обслуживании
- DIN EN ISO 13485 Системы обеспечения качества – медицинские устройства
- DIN EN ISO 14971 Медицинские устройства. Применение управления рисками к медицинским устройствам
- ISO/IEC 27001 «Информационные технологии. Методы обеспечения безопасности. Системы управления информационной безопасностью.
 Требования»
Требования» - DIN ISO 45001 Системы управления охраной труда и техникой безопасности. Требования и руководство по применению
- DIN EN ISO 50001 Системы энергоменеджмента. Требования и руководство по применению
- Регламент (ЕС) 2017/745 Совета по медицинским устройствам, вносящий поправки в Директиву 2001/83/ЕС, Регламент (ЕС) № 178/2002 и Регламент (ЕС) № 1223/2009 и отменяющий Директивы Совета 90/385/ЕЕС и 93/42/ЕЭС
- Регламент 1935/2004/ЕС Совета о материалах и изделиях, предназначенных для контакта с пищевыми продуктами, и отменяющий Директивы 80/590/ЕЕС и 89/109/ЕЕС
- Регламент 1223/2009/EC Совета по косметическим продуктам
- Регламент о регистрации, оценке, разрешении и ограничении использования химических веществ (REACH), учреждающий Европейское агентство по химическим веществам (ECHA)
- Европейская фармакопея (Ph.Eur.)
- Рабочие группы Европейского агентства по лекарственным средствам (EMA)
- Регламент 1935/2004/ЕС Совета о материалах и изделиях, предназначенных для контакта с пищевыми продуктами, и отменяющий Директивы 80/590/ЕЕС и 89/109/ЕЕС
- Регламент 528/2012/EC Совета о размещении на рынке и использовании биоцидных продуктов
- Регламент 1272/2008/ЕС Совета по классификации, маркировке и упаковке веществ и смесей, изменяющий и отменяющий Директивы 67/548/ЕЕС и 1999/45/ЕС и вносящий поправки в Регламент (ЕС) № 1907/2006
- Директива 93/42/EWG Совета по медицинским приборам
- Директива 2014/30/ЕС о сближении законов государств-членов, касающихся электромагнитной совместимости
- Директива 2001/83/ЕС Европейского парламента и Совета от 6 ноября 2001 г. о коде сообщества для лекарственных средств для человека
- Директива 2001/82/ЕС Европейского парламента и Совета от 6 ноября 2001 г. о кодексе сообщества, касающемся ветеринарных лекарственных средств
- Директива 2012/19/ЕС Совета по отходам электрического и электронного оборудования
- Директива 2011/65/ЕС Совета об ограничении использования некоторых опасных веществ в электрическом и электронном оборудовании
- Директива 89/686/ЕЕС Совета по средствам индивидуальной защиты
- Директива 2013/C 68/01 Совета по надлежащей практике распространения лекарственных средств для человека
- Закон о введении в действие закона о медицинских устройствах (MPDG — Medizinprodukterecht Durchführungsgesetz)
- Закон о наркотиках (AMG)
- Закон о наркотиках (BtMG)
- Закон о фармацевтической рекламе (HWG)
- Закон об обращении с отходами замкнутого цикла (KrWG)
- Закон о пищевых продуктах и кормах (LFGB)
- Закон об электрическом и электронном оборудовании (ElektroG)
- Закон о защите от опасных веществ (ChemG)
- Предписания для фармацевтических предприятий (насколько они применимы) (AMWHV)
- Распоряжение о предприятиях для оптовых фармацевтических компаний (AM-HandelsV)
- Регламент косметики (KosmetikV)
- Постановление об упаковке (VerpackV)
- Постановление о потребительских товарах (BedGgstV)
- Свод законов о социальном обеспечении (SGBV)
- Регламент BSI-Kritis (BSI-KritisV)
- Единая программа аудита медицинских изделий (MDSAP)
- 21 Свод федеральных правил (CFR) 820 (Федеральный закон США) (США)
- 21 Свод федеральных правил (CFR) 803, Отчет о медицинских устройствах (США)
- 21 Свод федеральных правил (CFR) 806, Отчеты об исправлениях и удалениях (США)
- 21 Свод федеральных правил (CFR) 807, Регистрация предприятий и список устройств (США)
- 21 Свод федеральных правил (CFR) 821, Отслеживание устройств (США)
- Канадские правила медицинского оборудования (CMDR)
- Закон Японии об обеспечении качества, эффективности и безопасности фармацевтических препаратов, медицинских устройств, продуктов регенеративной и клеточной терапии, продуктов генной терапии и косметики (Закон о PMD)
- MHLW MO169 (Япония)
- Положение о терапевтических товарах (медицинских изделиях) 2002 г.
 (Австралия)
(Австралия) - RDC ANVISA №. 16/2013 – Надлежащая производственная практика (Бразилия)
- RDC ANVISA №. 23/2012 (отчет о действиях на местах) (Бразилия)
- RDC ANVISA №. 67/2009 – Бдительность (Бразилия)
- Федерального закона от 6360/76 (Бразилия)
- RDC ANVISA №. 56/2001 – Основные требования безопасности и эффективности (Бразилия)
- 21 Свод федеральных правил (CFR) 210 (Федеральный закон США) Текущая надлежащая производственная практика производства, обработки, упаковки или хранения лекарственных средств, общая (США)
- 21 Свод федеральных правил (CFR) 211 (Федеральный закон США) Текущая надлежащая практика производства готовых лекарственных средств (США)
- Фармакопея США (USP), текущая версия
- Фармакопея Бразилии, текущая версия 1
- RDC 17/2010 (Лекарственные средства GMP) (Бразилия)
- Тайваньский закон о фармацевтике (Pal)
- 2014 г. № 650 Положения о надзоре и управлении медицинскими изделиями (Китай)
- 2014 г.
 № 64 Регламент GMP для Китая
№ 64 Регламент GMP для Китая - Регламент регистрации лекарственных средств (Приказ SFDA № 28; 2007 г.) (Китай)
- Надлежащая производственная практика фармацевтической продукции (пересмотрено в 2010 г.) Постановление № 79 Министерства здравоохранения (Китай)
- Фармакопея Китайской Народной Республики (текущая редакция)
- 2013 N 913 — Российские правила надлежащей производственной практики
- Федеральный закон N 323-ФЗ «Об охране здоровья населения в Российской Федерации»
- Приказ № 737н «Об утверждении Административного регламента регистрации медицинских изделий РЗН» (Россия)
- Приказ № 906 — Внесение изменений в перечень всей продукции, подлежащей процедуре соответствия в России
- № 184-ФЗ Федеральный закон «О техническом регламенте» (Россия)
- Постановление № 1416 «Нормативная база медицинских изделий» (Россия)
- № 214 10/2 — Правила технических, токсикологических и клинических испытаний (Россия)
- РС-002 Правила испытаний (Россия)
- Приказ МЗ РФ N 4нОб утверждении Номенклатурной номенклатуры изделий медицинского назначения и IVD (Россия)
- Приказ 174н – Мониторинг безопасности, качества и эффективности медицинских изделий (Россия)
- Приказ 175н «Об утверждении Порядка контроля безопасности медицинских изделий» (Россия)
- Приказ 12н – Сообщение о нежелательных явлениях (Россия)
- ГОСТ Р 51609-2000 – Классификация медицинских изделий по классам риска (Россия)
- МЗ №89 — Правила проведения испытаний изделий медицинского назначения с измерительной функцией (Россия)
- Закон Кореи о медицинском оборудовании
- Положение о надлежащей производственной практике (GMP) для лекарственных средств, Уведомление Министерства продовольствия и лекарственных средств № 2019-52, частично изменено 28 июня 2019 г.
 и введено в действие 29 июня 2020 г. (Корея)
и введено в действие 29 июня 2020 г. (Корея) - PIC-Руководство по надлежащей производственной практике для лекарственных средств
- Руководство по надлежащей лабораторной практике
- Руководство по надлежащей клинической практике
- Руководство ICH
- Руководство VICH
- Приложение 2 Надлежащая производственная практика ВОЗ для фармацевтических продуктов: основные принципы
- EudraLex – Том 4 – Руководство по надлежащей производственной практике (GMP)
.
Каждый из законов и стандартов учитывается в его актуальной версии.
Связь с соответствующими законами и постановлениями по охране окружающей среды : Применительно к местному производству термин «Промышленная охрана окружающей среды» описывает все действия, предпринимаемые в связи с экологически безопасным производством, которые направлены на поддержание чистоты воздуха , защита почвы и воды, предотвращение образования отходов, -сокращение, -переработка и -удаление, а также утилизация продуктов. Он соответствует следующим стандартам:
Он соответствует следующим стандартам:
- DIN EN ISO 14001: Система экологического менеджмента – спецификация с инструкциями по применению
- EMAS (насколько это применимо на местном уровне)
Законы об обеспечении экологически безопасного производства, связанные с защитой от выбросов, управлением водными ресурсами и переработкой отходов, должны соблюдаться каждым производственным предприятием, насколько это применимо на основе национального законодательства. Защита от иммиссии может регулировать установку и эксплуатацию установок и машин, оказывающих воздействие на окружающую среду, как с требованием официального разрешения, так и без него. Установленным ориентиром при эксплуатации таких установок и машин является их соответствие нормам современной техники. Поэтому уже при покупке новых установок и машин необходимо учитывать будущие разработки.
Управление водного хозяйства может регулировать обязанности по очистке сточных вод и защите подземных вод. Поэтому вводятся и применяются технические стандарты безопасности, а также методы очистки или директивы по предотвращению попадания сточных вод в общественную канализационную систему. Он может регулировать защиту почвы и грунтовых вод при обращении с загрязняющими воду веществами.
Поэтому вводятся и применяются технические стандарты безопасности, а также методы очистки или директивы по предотвращению попадания сточных вод в общественную канализационную систему. Он может регулировать защиту почвы и грунтовых вод при обращении с загрязняющими воду веществами.
Правила, касающиеся отходов, могут регулировать надлежащее недопущение, переработку и утилизацию отходов от их производства до их окончательного удаления (например, складирование отходов).
Условия, установленные органами в области охраны окружающей среды: Эксплуатация установок и машин, требующих официального разрешения, и осуществление природоохранной деятельности могут подлежать проверке со стороны официальных органов. Эти условия фиксируются для каждой производственной площадки в табличной форме в Заявлении об охране окружающей среды для конкретной площадки, насколько это применимо. Руководящий персонал станции обеспечивает соблюдение этих условий.
Aesculap AG
Основные стандарты:
- EN ISO 9001:2015 Система менеджмента качества
- EN ISO 13485:2016 Изделия медицинские.
 Системы управления качеством Требования для целей регулирования
Системы управления качеством Требования для целей регулирования - EN ISO 14971:2019 Управление рисками
- EN ISO 14001:2015 Экологический менеджмент
- BS OHSAS 18001:2018 Охрана труда и управление здравоохранением
- DIN ISO 45001:2018 Системы управления охраной труда и техникой безопасности. Требования и руководство по применению
- EN ISO 50001:2018 Управление энергопотреблением
Нормативно-правовые акты:
- AIMD 90/385/EEC (2007/47/EC) Активные имплантируемые медицинские устройства
- Закон о наркотиках AMG
- AM-HandelsV Регламент работы оптовых торговцев лекарственными средствами
- Закон о безопасности труда ASiG
- Положения BGV о социальном страховании от несчастных случаев на производстве
- CGMP Китайская GMP для медицинских устройств
- CMDR (SOR/98-282) Канадские правила медицинского оборудования
- EMAS (EG 1221/2009) Схема аудита управления ECO
- Регламент энергосбережения EnEV
- Закон о сокращении EnEG для энергии в зданиях
- Закон EnWG об энергетике
- Закон MDA о медицинских устройствах, включая KGMP (Корейская надлежащая производственная практика)
- MDD 93/42/EEC (2007/47/EC) Директива по медицинскому оборудованию
- MDR 2017/745 Постановление о медицинских изделиях
- Закон Германии о медицинских изделиях на галлон (заменено)
- MPEUAnpG Medizinprodukte-EU-Anpassungsgesetz
- MPDG Das Medizinprodukterecht-Durchführungsgesetz
- MPAMIV Medizinprodukte-Anwendermelde- und Informationsverordnung
- Закон о фармацевтике PAA Тайвань
- Закон о PMD, Миссури.
 169 Закон о фармацевтических и медицинских устройствах Японии
169 Закон о фармацевтических и медицинских устройствах Японии - RDC 16:2013 Резолюция Бразилия
- Правила TGA (TG(MD)R) Австралийские правила медицинского оборудования
- 21 CFR QSR 820 Правила системы качества FDA
Avitum
Основные стандарты:
- EN ISO 13485:2016 Медицинские изделия. Системы управления качеством Требования для целей регулирования
- EN ISO 14971:2019 Управление рисками
- EN ISO 14001:2015 Экологический менеджмент
- DIN ISO 45001:2018 Системы управления охраной труда и техникой безопасности. Требования с руководством по применению
- EN ISO 50001:2018 Управление энергопотреблением
Нормативно-правовые акты:
- CGMP Китайский стандарт GMP для медицинских устройств
- CMDR (SOR/98-282) Канадские правила медицинского оборудования
- Закон MDA о медицинских устройствах, включая KGMP (Корейская надлежащая производственная практика)
- Европейская директива 93/42/EEC (2007/47/EC) Директива о медицинских устройствах (MDD)
- Европейский регламент (ЕС) 2017/745 Регламент медицинских устройств (MDR)
- MPEUAnpG Medizinprodukte-EU-Anpassungsgesetz
- MPDG Medizinprodukterecht-Durchführungsgesetz
- MPAMIV Medizinprodukte-Anwendermelde- und Informationsverordnung
- RDC 16:2013 Бразильская резолюция GMP для медицинских устройств
- Правила TGA (TG(MD)R) Австралийские правила медицинского оборудования
- 21 CFR Part 820 Регламент системы качества FDA
- Европейские директивы 2001/83/EC и 2008/29/EC о своде правил, касающихся лекарственных средств для человека
- Европейская директива 2003/94/EC о принципах и руководящих принципах надлежащей производственной практики в отношении лекарственных средств для применения человеком и исследуемых лекарственных средств для применения человеком
- Европейский регламент (ЕС) 726/2004 по выдаче разрешений и надзору за лекарственными препаратами для человека и ветеринарии
- Европейский регламент (ЕС) 658/2014 о проведении мероприятий по фармаконадзору
- Европейская директива 2001/20/EC по GCP и клиническим испытаниям, Изменения в области фармаконадзора в 12-й поправке к Закону Германии о лекарственных средствах
- Европейская директива о фальсифицированных лекарственных средствах (2011/62/EU)
- Европейское руководство 2013/C343/01 по надлежащей практике распространения лекарственных средств для человека (EU-GDP)
- Европейская фармакопея (Ph.



 Требования»
Требования» (Австралия)
(Австралия) № 64 Регламент GMP для Китая
№ 64 Регламент GMP для Китая и введено в действие 29 июня 2020 г. (Корея)
и введено в действие 29 июня 2020 г. (Корея) Системы управления качеством Требования для целей регулирования
Системы управления качеством Требования для целей регулирования 169 Закон о фармацевтических и медицинских устройствах Японии
169 Закон о фармацевтических и медицинских устройствах Японии